Общая характеристика лекарственного препарата (ОХЛП) и Листок-вкладыш (ЛВ) как формы информации о препаратах

Раньше пациенты и врачи получали информацию о лекарственных препаратах из Инструкции по медицинскому применению
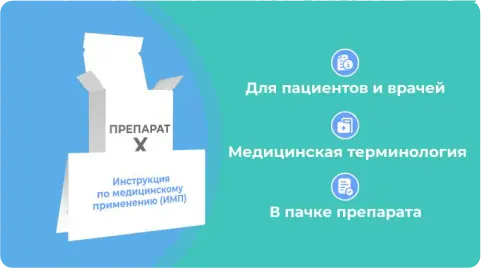
В инструкции содержалось много сложной информации для пациентов, а врачам, наоборот, было бы полезно получить более развернутую медицинскую информацию.

ЕАЭС регулированием предусмотрено 2 отдельных документа: Листок-вкладыш — для пациентов и Общая характеристика лекарственного препарата для медицинского применения, адресованная
врачам.
врачам.
ЛВ
- Для пациентов
- Удобочитаемый текст
- Отсутствует неактуальная для пациента информация
- В пачке препарата

ОХЛП
- Для врачей
- Медицинская терминология
- Вся информация актуальная для врача
- Только онлайн


Листок-вкладыш находится внутри упаковки препарата, а также доступен онлайн.

Теперь представлена развернутая информация о клинических исследованиях, фармакокинетике, а также добавлены новые важные разделы, например данные о доклинической безопасности и cовместимости с другими лекарственными препаратами.
 Таким образом, информация о лекарственном препарате стала более доступной и понятной для всех.
Таким образом, информация о лекарственном препарате стала более доступной и понятной для всех.
Вернуться на страницу
Национальные требования VS
ЕАЭС требования
Национальная регистрация
Инструкция по медицинскому применению
- ФЗ № 61 от 12.04.2010 «Об обращении лекарственных средств»
- Приказ МЗ N 724н от 21.09.2016 «Об утверждении требований к инструкции по медицинскому применению»
- Руководство по экспертизе лекарственных средств / Под. ред. проф. А.Н. Миронова
ЕАЭС
ОХЛП — Общая характеристика лекарственного препарата для медицинского применения
ЛВ — Листок-вкладыш
- Решение Совета Евразийской экономической комиссии от 03.11.2016 № 78 «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения»
- Решение Совета Евразийской экономической комиссии № 88 от 3 ноября 2016 г. «Об утверждении требований к инструкции по медицинскому применению лекарственных препаратов и общей характеристике лекарственных препаратов для медицинского применения»
- «Пользовательское тестирование» приложение 14 Решения № 88 от 3 ноября 2016 г.
Вернуться на страницу
Вернуться на страницу
Таблица соответствия разделов ИМП и ОХЛ
| ИМП | ОХЛП |
|---|---|
| Регистрационный номер | 8. Номер регистрационного удостоверения |
| Торговое наименование | 1. Наименование лекарственного препарата |
| МНН | — |
| Лекарственная форма | 3. Лекарственная форма |
| Описание | 3. Лекарственная форма |
| Состав | 2. Качественный и количественный состав 6.1. Перечень вспомогательных веществ |
| Фармакотерапевтическая группа | 5.1. Фармакодинамические свойства |
| Код АТХ | 5.1. Фармакодинамические свойства |
| Фармакодинамика | 5.1. Фармакодинамические свойства |
| Фармакокинетика | 5.2. Фармакодинамические свойства |
| Показания к применению | 4.1. Показания к применению |
| Противопоказания | 4.3. Противопоказания |
| С осторожностью | 4.4. Особые указания и меры предосторожности при применении |
| Применения при беременности и в период грудного вскармливания | 4.6. Фертильность, беременность и лактация |
| Способ применения и дозы | 4.2. Режим дозирования и способ применения |
| Побочное действие | 4.8. Нежелательные реакции |
| Передозировка | 4.9. Передозировка |
| Взаимодействие с другими ЛС | 4.5. Взаимодействие с другими ЛП и другие виды взаимодействия |
| Особые указания | 4.4. Особые указания и меры предосторожности при применении |
| Влияние на способность управлять транспортными средствами и механизмами | 4.7. Влияние на способность управлять транспортными средствами и работать с механизмами |
| Форма выпуска | 6.5. Характер и содержание первичной упаковки |
| Условия хранения | 6.4. Особые меры предосторожности при хранении |
| Срок годности | 6.3. Срок годности (срок хранения) |
| Условия отпуска | — |
| Наименование и адрес юридического лица, на имя которого выдано РУ | 7. Держатель регистрационного удостоверения |
| Наименование и адрес места осуществления производства ЛП | — |
| Организация, принимающая претензии от потребителей | 7.1. Представитель держателя регистрационного удостоверения |
| 5.3. Данные доклинической безопасности | |
| 6.2. Несовместимость | |
| 6.6. Особые меры предосторожности при уничтожении использованного ЛП или отходов, полученных после применения ЛП и другие манипуляции с препаратом | |
| 9. Дата первичной регистрации (подтверждения регистрации, перерегистрации) | |
| 10. Дата пересмотра текста |
Вернуться на страницу
Где найти ОХЛП и ЛВ
| ОХЛП | ЛВ | |
|---|---|---|
| Государственный Реестр Лекарственных Средств (ГРЛС)* |
- | + |
| Научный центр экспертизы средств медицинского применения* |
+ | + |
| Сайты компаний производителей | +/- | +/- |
| Единый реестр зарегистрированных лекарственных средств Евразийского экономического союза* |
+ | + |











